- Формула аминокислоты цистеина
- Цистеин в продуктах питания
- Цистеин содержит уникальную тиоловую группу
- Источники цистеина
- Цистеин — компонент белков
- Биосинтез цистеина
- Синтез цистеина в организме
- Биосинтез цистеина
- Предшественник антиоксиданта глутатиона
- Связывание ионов металлов
- Показания к применению
- Особенности приема и взаимодействия
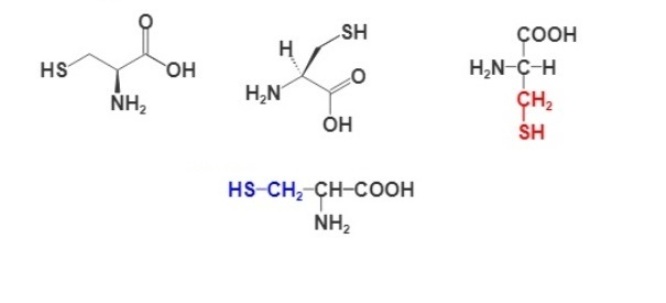
Формула аминокислоты цистеина
Для изображения строения аминокислот используют разные формулы. Ниже представлены несколько вариантов написания структурной формулы цистеина.
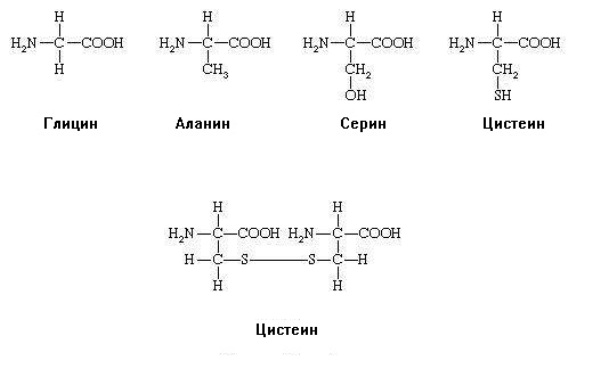
Все аминокислоты имеют амино- и карбоксильную группы, присоединенные к α-углеродному атому, и отличаются только строением радикала, присоединенному к этому же атому углерода. Например, ниже представлены структурные формулы аланина, цистеина и глицина, серина а также цистина.
Все аминокислоты имеют одинаковый остов и разные радикалы. Именно строение радикала лежит в основе квалификации аминокислот и определяет свойства самой молекулы. У цистеина формула радикала — СН2-SH. Этот радикал относится к группе полярных незаряженных, гидрофильных. Это значит, что участки белка, содержащие цистеин, могут присоединять воду (гидратироваться) и взаимодействовать при помощи водородных связей с другими участками белка, также содержащими аминокислоты с гидрофильными группами.
Цистеин в продуктах питания
Хотя цистеин классифицируется как заменимая аминокислота, в редких случаях он может быть жизненно важен для младенцев, пожилых людей и лиц с определенными метаболическими заболеваниями или людей, страдающими от синдрома мальабсорбции. В нормальных физиологических условиях, при наличии достаточного количества доступного метионина, цистеин может быть синтезирован в организме человека.

Цистеин катаболизируется в желудочно-кишечном тракте и плазме крови. В отличие от цистеина, цистин благополучно проходит через желудочно-кишечный тракт и плазму крови и до проникновения в клетку стремительно делится на две молекулы цистеина.
Цистеин содержится в большинстве продуктов с высоким содержанием белка.
Животные источники: свинина, колбаса, курица, индейка, утка, мясо, яйца, молоко, сывороточный протеин, рикотта, творог, йогурт.
Растительные источники: красный перец, чеснок, лук, брокколи, брюссельская капуста, овес, мюсли, зародыши пшеницы, проросшая чечевица.
Как и другие аминокислоты, цистеин является амфотерным соединением.
Цистеин содержит уникальную тиоловую группу
Цистеин — уникальная аминокислота. Она единственная среди 20 природных аминокислот содержит тиоловую (-HS) группу. Тиоловые группы могут подвергаться окислительным и восстановительным реакциям. При окислении тиоловой группы цистеина образуется цистин — аминокислота, представляющая собой два цистеиновых остатка, соединенных дисульфидной связью.
Окисление тиоловой группы цистеина приводит к образованию дисульфидной связи с другим тиолом, в ходе дальнейшего окисления образуются сульфиновые и сульфоновые кислоты.
Благодаря способности вступать в окислительно-восстановительные реакции, цистеин обладает антиоксидантными свойствами.
Источники цистеина

Ежедневно человек должен потреблять 4,1 мг цистеина на 1 кг веса. То есть в организм человека с массой 70 кг должно поступать 287 мг этой аминокислоты в день.
Часть цистеина может синтезироваться в организме, часть поступает с пищей. Ниже приведен список продуктов, содержащих максимальное количество аминокислоты.
| Содержание цистеина в продуктах | |
| Продукт | Содержание цистеина в 100 г продукта, мг |
| Соевые продукты | 638 |
| Говядина и баранина | 460 |
| Семена (подсолнечника, арбуза, кунжута, льна, тыквы) и орехи (фисташки, кедровые) | 451 |
| Куриное мясо | 423 |
| Овес и овсяные отруби | 408 |
| Свинина | 388 |
| Рыба (тунец, лосось, окунь, скумбрия, палтус) и моллюски (мидии, креветки) | 335 |
| Сыр, молочные продукты и яйца | 292 |
| Бобовые (нут, бобы, фасоль, чечевица) | 127 |
| Крупы (гречка, ячмень, рис) | 120 |
Кроме того, цистеин содержится в красном перце, чесноке, луке, в темных листовых овощах — брюссельской капусте, брокколи.
Производят пищевые добавки, например, L-цистеин гидрохлорид, N-ацетилцистеин. Второй обладает большей растворимостью и легче усваивается организмом.
В промышленности L-цистеин получают гидролизом из перьев птиц, щетины и человеческих волос. Производится более дорогой синтетический L-цистеин, подходящий под мусульманские и еврейские пищевые правила (в соответствии с религиозными аспектами).
В форме кислоты входят в состав многих белков и природных пептидов. Особенно высоко содержание цистина в кератинах, которые в свою очередь явaляются производным белка ногтей, кожи и волос.
Пищевые источники цистина: рыба, овес, соя, рис, пшеница, яичный желток, лук и чеснок.
В промышленности L-цистеин получают в основном с помощью гидролиза птичьих перьев или человеческого волоса. Кроме того, производится более дорогой синтетический L-цистеин, подходящий под еврейские кошерные и мусульманские халяльные правила. В ходе синтетического производства L-цистеина осуществляется ферментация с использованием мутантов E.coli.
Цистеин — компонент белков
В ходе трансляции мессенджера РНК молекул для получения полипептидов, цистеин кодируется кодонами UGU и УГК.
Цистеин традиционно считается гидрофильной аминокислотой, основанной главным образом на химических параллелях между тиольной группой и гидроксильными группами в боковой цепи других полярных аминокислот.
Тем не менее, было показано, что боковая цепь цистеина стабилизирует гидрофобные взаимодействия в мицеллах в большей степени, чем боковые цепи неполярной аминокислоты глицина и полярной аминокислоты серина. В статистическом анализе измерения частоты проявления аминокислот в различных средах в химической структуре белков, свободные цистеиновые остатки ассоциировались с гидрофобными участками белков.
Их гидрофобная тенденция эквивалентна известным неполярным аминокислотам, таким как метионин и тирозин, и намного больше, чем у известных полярных аминокислот, таких как серин и треонин. При определении значений гидрофобности, подразделяющих аминокислоты на наиболее гидрофобные или наиболее гидрофильные, цистеин относят к гидрофобным аминокислотам.
Такие методы основаны на процедурах, которые не влияют на тенденцию цистеина к формированию дисульфидных связей в белках, поэтому цистеин считается гидрофобной аминокислотой, хотя иногда его также классифицируют как малополярную или полярную аминокислоту.
В то время как в белках встречаются свободные остатки цистеина, большинство ковалентно связано с другими остатками цистеина, образуя дисульфидные связи.
Дисульфидные связи играют важную роль в фолдинге и стабильности некоторых белков, особенно белков, секретируемых во внеклеточной среде. Так как большинство клеточных компартментов представляют из себя восстановительную среду, дисульфидные связи в цитозоле являются обычно нестабильными, однако есть и некоторые исключения.
Дисульфидные связи в белках образуются путем окисления тиоловых групп остатков цистеина. Другая серосодержащая аминокислота, метионин, не может образовывать дисульфидных связей. Более агрессивные окислители преобразуют цистеин в соответствующие сульфиновую и сульфоновую кислоты. Остатки цистеина играют важную роль, образуя поперечные связи между белками, что повышает жесткость белков, а также создает протеолитическое сопротивление (так как экспорт белков является дорогостоящей процедурой, приветствуется всевозможная ее минимизация).
Внутри клетки дисульфидные мостики между остатками цистеина в полипептиде поддерживают третичную структуру белка. Инсулин является примером белка, имеющим поперечные связи цистина, где две отдельные пептидные цепи соединены парой дисульфидных связей.
Изомеразы дисульфида белка катализируют соответствующие образования дисульфидных связей;
клетка передает дегидроаскорбиновую кислоту в эндоплазматический ретикулум, который окисляет среду. В этой среде цистеин окисляется в цистин и больше не функционирует в качестве нуклеофила.
Помимо окисления в цистин, цистеин участвует в многочисленных посттрансляционных модификациях. Нуклеофильная тиоловая группа позволяет цистеину объединяться с другими группами, например, при пренилировании.
Убиквитин лигазы передают убиквитин в боковую цепь, в белки и каспазы, которые осуществляют протеолиз в цикле апоптоза. Интеины часто функционируют при помощи каталитического цистеина. Их функционирование обычно ограничено внутриклеточной восстановительной средой, где цистеин не окисляется в цистин.
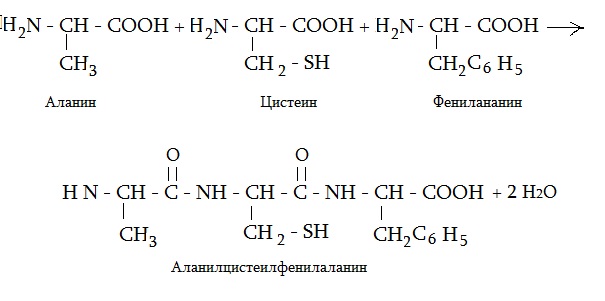
Аминокислоты, входящие в состав белков, называют протеиногенными. Как уже было сказано, их 20, и цистеин — один из них. Для формирования первичной структуры белка аминокислоты соединяются между собой в длинную цепь. Соединение идет за счет групп остова аминокислот, радикалы в этом не участвуют. Связь между аминокислотами образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты. Связь, образованная таким образом, между двумя аминокислотами, называется пептидной.
На рисунке представлена формула трипептида аланин цистеин фенилаланин и схема его образования.
Самым мелким пептидом в организме является глутатион, в состав которого входят всего две аминокислоты, в том числе и цистеин. Две аминокислоты, соединенные между собой, называют дипептидом, три — трипептидом. Приведем еще формулу трипептида из аланина, лизина и цистеина.
Вещества, содержащие от 10 до 40 аминокислот, называют полипептидами. В состав собственно белков входит более 40 аминокислотных остатков. Цистеин входит в состав многих пептидов и белков, например, инсулина.
Биосинтез цистеина
У животных биосинтез цистеина начинается с аминокислотысерина. Сера является производным метионина, который превращается в гомоцистеин через промежуточное вещество S-аденозилметионин. Затем в ходе цистатионин бета-синтазы гомоцистеин и серин объединяются, образуя асимметричный тиоэфирный цистатионин.
Фермент цистатионин гамма-лиазы преобразует цистатионин в цистеин и альфа-кетобутират. У растений и бактерий биосинтез цистеина начинается с серина, который превращается в O-ацетилсерин с помощью фермента трансантелазы серина. Фермент O-ацетилсерин (тиол)-лиазы, используя сульфидные источники, преобразует этот эфир в цистеин, выпуская уксусную кислоту.
Синтез цистеина в организме
- Участвует в формировании пространственных структур ряда белков и пептидов, например инсулина, соматостатина и иммуноглобулинов.
- Участвует в процессах формирования тканей кожи, способствует формированию коллагена и улучшает эластичность и текстуру кожи.
- Помогает обезвреживать некоторые токсические вещества и защищает организм от повреждающего действия радиации.
- Является антиоксидантом, причем его антиоксидантное действие усиливается при одновременном приеме витамина С и селена.
- Является предшественником глютатиона – вещества, оказывающего защитное действие на клетки печени и головного мозга от повреждения алкоголем, некоторых лекарственных препаратов и токсических веществ, содержащихся в сигаретном дыме.
Цистеин тиольная группа является нуклеофильной и легко окисляется. Ее реактивность усиливается при ионизации тиола, и остатки цистеина в белках имеют значения рКа, близкие к нейтральным. Из-за своей высокой реакционной способности тиоловая группа цистеина осуществляет многочисленные биологические функции.
Цистеин, наряду с тирозином, относится к условно заменимым аминокислотам. Это значит, что они могут синтезироваться в организме, но только из незаменимых аминокислот: цистеин из метионина, тирозин из фенилаланина.
Для синтеза цистеина необходимы две аминокислоты — незаменимая метионин и заменимая серин. Метионин является донором атома серы. Цистеин синтезируется из гомоцистеина в ходе двух реакций, катализируемых пиридоксальфосфатом. Генетические нарушения, а также недостаток витаминов В9 (фолиевой кислоты), В6 и В12 приводят к нарушению использования фермента, гомоцистеин превращается не в цистеин, а в гомоцистин. Это вещество накапливается в организме, вызывая заболевание, сопровождающееся катарактой, остеопорозом, умственной отсталостью.
Синтез в организме может быть недостаточен у пожилых людей и младенцев, лиц с некоторыми метаболическими заболеваниями, страдающих синдромом мальабсорбции.
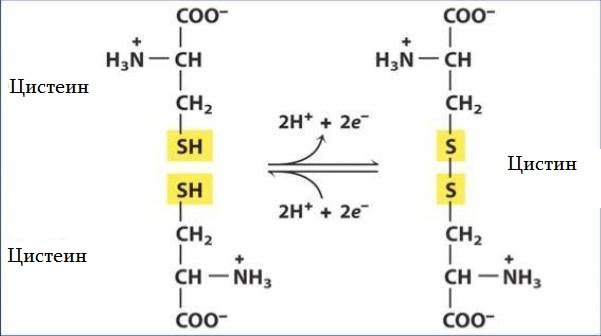
За счет тиоловой группы (-HS) в составе формулы цистеина, в белках формируются дисульфидные связи, называемые дисульфидными мостиками. Дисульфидные связи — ковалентные, сильные. Они образуются между двумя молекулами цистеина в составе белка. Могут образовываться внутрицепочечные мостики в пределах одной полипептидной цепочки, и межцепочечные — между отдельными цепями белка. Например, в структуре инсулина имеют место оба вида мостиков. Эти связи обеспечивают поддержание третичной и четвертичной структуры белка.
Дисульфидные связи содержат в основном внеклеточные белки. Например, этот вид связи имеет большое значение в стабилизации структуры инсулина, иммуноглобулинов и пищеварительных ферментов. Белки, содержащие множество дисульфидных мостиков, более устойчивы к тепловой денатурации, что позволяет им поддерживать свою активность в более экстремальных условиях.
Особенности формулы цистеина обеспечивают ему антиоксидантные свойства. Цистеин играет роль антиоксиданта, вступая в реакции окисления-восстановления. Тиоловая группа имеет высокое сродство к тяжелым металлам, поэтому белки, содержащие цистеин, связывают металлы, такие как ртуть, свинец и кадмий. В составе белка рК цистеина такой, что это обеспечивает нахождение аминокислоты в реактивной тиолятной форме, то есть цистеин легко отдает HS-анион.
Цистеин является важным источником серы в метаболизме.
За счет наличия тиоловой группы, легко вступающей в реакции, цистеин участвует в разнообразных процессах в организме и выполняет многие функции.
- Обладает антиоксидантными свойствами.
- Участвует в синтезе глутатиона.
- Участвует в синтезе таурина, биотина, коэнзима А, гепарина.
- Участвует в образовании лимфоцитов.
- Входит в состав β-кератина, участвующего в формировании тканей кожи, волос, слизистой пищеварительной системы.
- Способствует обезвреживанию некоторых токсических веществ.
Биосинтез цистеина
В организме животного цистеин синтезируется непосредственно из серина, а источником серы является метионин. Метионин превращается в гомоцистеин через промежуточные вещества S-AM и S-АГ. S-аденозилметионин — активная форма метионина, образуется соединением АТФ и метионина. Выступает донором метильной группы в реакциях синтеза различных соединений: цистеина, адреналина, ацетилхолина, лецитина, карнитина.
В результате трансметилирования S-AM превращается в S-аденозилгомоцистеин (S-АГ). Последний в ходе гидролиза образует аденозин и гомоцистеин. Гомоцистеин соединяется с серином с участием фермента цистатионин-β-синтазы с образованием тиоэфирного цистатионина. Цистатионин превращается в цистеин и α-кетобутират под действием фермента цистатионин-γ-лиазы.
У растений и бактерий синтез происходит иначе. Источником серы для синтеза цистеина могут выступать разные вещества, даже сероводород.
Предшественник антиоксиданта глутатиона
Благодаря способности тиолов вступать в окислительно-восстановительные реакции, цистеин обладает антиоксидантными свойствами. Антиоксидантные свойства цистеина, как правило, выражаются в трипептидном глутатионе, который встречается у человека и других организмов. Системная доступность перорального глютатиона (GSH) незначительна, поэтому он должен быть синтезирован из составляющих его аминокислот – цистеина, глицина и глутаминовой кислоты.
Цистеин является важным источником сульфида в метаболизме человека. Кластеры сульфида железа и серы в нитрогеназе извлекаются из цистеина, который в ходе этого процесса преобразуется в аланин.
Связывание ионов металлов
Кроме железо-серных белков, в ферментах существует множество других кофакторов металла, связанных с тиолатным заместителем остатков цистеинила. Примеры включают цинк в «цинковых пальцах» и алкогольдегидрогеназу, медь в синих белках меди, железо в цитохроме Р450 и никель в [NiFe] гидрогеназе. Тиольная группа также имеет высокое сродство к тяжелым металлам, так что белки, содержащие цистеин, такие как металлотионеин, способны связывать такие металлы, как ртуть, свинец и кадмий.
Показания к применению
Цистеин нашел широкое применение в медицинской, фармацевтической, пищевой промышленности.
Цистеин часто используют при лечении различных заболеваний:
- При бронхите и эмфиземе легких, так как он разжижает слизь.
- При ревматоидном артрите, заболеваниях вен и при раке.
- При отравлениях тяжелыми металлами.

Кроме того, цистеин ускоряет выздоровление после операций и ожогов, активизирует лейкоциты.
Цистеин ускоряет сжигание жиров и построение мышечной ткани, поэтому его часто применяют спортсмены.
Аминокислота применяется как ароматизатор. Цистеин является зарегистрированной пищевой добавкой Е920.
- Необходимость улучшить состояние кожных покровов,
- Ускорение регенерации волос и ногтевых пластинок,
- Медленное заживление ран, царапин, ссадин.
Цистеин, в основном L-энантиомер, является исходным сырьем в пищевой, фармацевтической и медицинской промышленности. Очень часто цистеин используется для создания запахов. Например, в результате взаимодействия цистеина с сахаром в ходе реакции Майяра можно ощутить ярко выраженный запах мяса. L-цистеин также используется в качестве технологической добавки в кулинарии для выпечки.
В Азии цистеин используется как средство для перманентной завивки волос, так как он способен разрушать дисульфидные связи кератина волос.
Цистеин очень широко используется в исследованиях структуры и динамики биомолекул. Малеимиды выборочно присоединяются к цистеину помощью ковалентного присоединения Михаэля.
Цистеин также широко используется в спиновых метках ЭПР (электронно-парамагнитного резонанса) или парамагнитной релаксации расширенного ЯМР (ядерного магнитного резонанса).
В докладе, опубликованном в 1994 пятью ведущими сигаретными компаниями, цистеин был описан как «одна из 599 сигаретных добавок».
Как и в случае большинства сигаретных добавок, конкретная цель его включения неизвестна. Его можно объяснить, например, тем, что он действует в качестве отхаркивающего средства, так как курение увеличивает выработку слизи в легких, а также может увеличивать уровень полезного антиоксиданта глутатиона (который у курильщиков уменьшается).
Цистин (3,3′-дитио-бис-2-аминопропионовая кислота, дицистеин).
HOOCCH(NH2)CH2SSCH2CH(NH2)COOH
L-Цистин — заменимая некодируемая аминокислота, не включается в пептидную цепь при ее биосинтезе, а образуется в результате ферментативного окисления остатков двух молекул цистеина (в т. ч. из разных полипептидных цепей).
Представляет собой бесцветные кристаллы, растворимые в воде. Образуется при окислении цистеина кислородом воздуха в щелочных растворах.
Аминокислоты метионин, цистеин и цистин метаболически тесно связаны друг с другом. Благодаря наличию в составе цистеина высокореактивной SH-группы в тканях легко осуществляется ферментативная окислительно-восстановительная реакция между цистеином и цистином. Цистеин образует с цистином окислительно-восстановительную пару, причем цистин играет роль восстановителя.
Особенности приема и взаимодействия
Цистеин был предложен в качестве профилактического средства или даже противоядия некоторым негативным эффектам алкоголя, в том числе повреждений печени и похмелья. Он противодействует ядовитому воздействию ацетальдегида, основного побочного продукта метаболизма алкоголя и отвечает за большинство отрицательных последствий и долгосрочных повреждений, связанных с употреблением алкоголя (но не отменяет непосредственного эффекта опьянения).
Цистеин поддерживает следующий шаг в метаболизме, в ходе которого ацетальдегид превращается в относительно безвредную уксусную кислоту. В исследовании на крысах, тестовым животным давали полулетальную дозу ацетальдегида. 80% крыс, получивших цистеин, выжили. Животные, получившие цистеин вместе с тиамином, выжили все до одного. Еще не существует прямых доказательств эффективности цистеина у людей, употребляющих алкоголь регулярно, но не злоупотребляющих им.
Совместное применение цистина и витаминов В1 и С снижает эффективность инсулина. При сахарном диабете принимать только по назначению врача.
Цистеин — аминокислота для парентерального питания. Отпускается из аптек по рецепту врача.
Читать еще: Берактант , Лейцин , Метандростенолон (Дианабол, Метандиенон) , Супердрол (метилдростонолон) , Эноксолон ,





